Что такое вода?
Часть первая - "Физика и химия
в одном стакане".
 Вопрос кажется банальным, но…
Вопрос кажется банальным, но…
Во-первых, это среда где обитают рыбки, и эта среда
должна нравиться им, а не вам.
Во-вторых, это казалось бы знакомая с детства Н2О,
о которой казалось бы все знают все, но оказывается, что знают не так уж и
много. Кроме того, в воде протекает много процессов и присутствует почти вся таблица Менделеева. Причем
количество элементов и соединений должно быть не больше и не меньше положенного.
И знания по физике и химии будут здесь далеко не лишними.
Физические свойства воды.

Вода – одно
из самых удивительных веществ в природе. Например, долгое время воду считали
элементом, и только в 1784 году англичанин Генри Кавендиш показал, что вода
состоит из более простых веществ - водорода и кислорода.
Ее теплоемкость – 4,1868 кДж/кг, что почти
вдвое превышает таковую растительных масел, ацетона, фенола, глицерина,
спирта, парафина. До сих пор дискутируется проблема 37 градусной температуры в
животном мире. Как известно, при нагревании любого вещества теплоемкость его
возрастает. Любого, кроме воды: при ее нагревании от 0 до 37 градусов
теплоемкость падает, и лишь при дальнейшем нагревании начинает возрастать.
Этот факт означает, что при 36 – 37 градусах для повышения температуры
некоторого объема воды необходимо минимальное количество тепла. Видимо, именно
это свойство воды явилось селектирующим фактором эволюции в выработке
теплокровности на уровне 37 градусов Цельсия.
Этим не исчерпываются парадоксы воды: ее аналоги - соединения
элементов группы кислорода с водородом (сероводород, селенистый водород,
теллуристый водород) – при наших земных условиях – газы с температурой кипения
минус 61, минус 42 и минус 4 градуса соответственно. Экстраполируя этот ряд,
получим ожидаемую температуру кипения воды - минус 70 градусов, а температуру
замерзания – минус 90 градусов. Как видим, и тут вода - исключение.
Среди необычных свойств воды трудно обойти вниманием еще одно
- ее исключительно высокое поверхностное натяжение 0,073 Н/м (при 20оС).
Из всех жидкостей более высокое поверхностное натяжение имеет только ртуть.
Вот еще пример аномалии воды: необычное температурное
поведение ее сжимаемости, то есть степени уменьшения объема при увеличении
давления . Обычно сжимаемость жидкости растет с температурой: при высоких
температурах жидкости более рыхлы (имеют меньшую плотность) и их легче сжать.
Вода обнаруживает такое нормальное поведение только при высоких температурах.
При низких же сжимаемость ведет себя противоположным образом, в результате
чего в ее температурном поведении появляется минимум при 45оС
Весьма плохо вода испаряется; если бы не это, то многие озера
и реки пересыхали бы. Плотность воды тоже удивляет: при охлаждении она
увеличивается только до температуры плюс 4 градуса, а далее вновь уменьшается.
Это означает, что самая тяжелая вода именно при плюс 4 и она опускается на
дно, а из более холодной формируется ледяной покров, но на поверхности! То
есть, вода как бы создана для того, чтобы в ней водилось что-либо живое, даже
при температуре ниже нуля: замерзание никогда не начнется со дна, а только с
поверхности.
Но самое, пожалуй, удивительное свойство воды – это свойство
практически универсального растворителя. И если какие-то вещества в ней не
растворяются, то и это для жизни сыграло громадную роль в эволюции: скорее
всего именно гидрофобным свойствам первичных биологических мембран и обязана
жизнь своим появлением и развитием в водной среде.
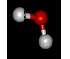 Вода
имеет полярную молекулу. Кислород как более электроотрицательный атом
оттягивает на себя общую с атомом водорода электронную плотность к себе и
потому несет частичный отрицательный заряд; атомы водорода, от которых
электронная плотность смещена, несут частичный положительный заряд. Таким
образом, молекула воды представляет собой
диполь,
т.е. имеет положительно и отрицательно заряженные участки.
Вода
имеет полярную молекулу. Кислород как более электроотрицательный атом
оттягивает на себя общую с атомом водорода электронную плотность к себе и
потому несет частичный отрицательный заряд; атомы водорода, от которых
электронная плотность смещена, несут частичный положительный заряд. Таким
образом, молекула воды представляет собой
диполь,
т.е. имеет положительно и отрицательно заряженные участки.
Атомы водорода и кислорода,
образующие воду, или окись водорода, могут иметь различные массовые числа и
отличаться друг от друга своими физико-химическими свойствами, но при этом они
имеют одинаковый электрический заряд атомных ядер и поэтому занимают в
периодической системе элементов одно и то же место. Такие разновидности атомов
одного и того же химического элемента называются изотопами. Известны пять
водородов и пять кислородов. Правда, по два из них (4H, 5H, 14O и 15O)
радиоактивны и очень короткоживущи. Например, длительность существования
водорода 4*10-11 сек. Наиболее широко известны следующие изотопы водорода:
протий 1H( с относительной атомной массой 1), дейтерий 2H, или D ( c
относительной атомной массой 2) и тритий 3H, или T ( c относительной атомной
массой 3), наиболее тяжелый, но слаборадиоактивный водород ( его период
полураспада 12,3 года), и изотопы кислорода: 16O, 17O и 18O. Эти шесть
изотопов могут образовывать 18 изотопических разновидностей воды: 1Н216О;
1НD16О; D216О ; 1НT16О; DT16О; T2О16; 1Н217О; 1НD17О; D217О; 1НT17О; DT17О;
T217О; 1Н218О; 1НD18О; D218О; 1НT18О; DT18О; T218О.
Говоря о химических
свойствах воды, прежде всего необходимо отметить её атмосферность:
H2O
↔ Н+
+ ОН-
Из уравнения электролитической диссоциации воды видно, что она может быть
как кислотой, так и основанием:
|
NH3
+ H2O |
↔ |
NH4+
+ ОН- |
кислота |
|
|
|
|
|
|
HNO3
+ H2O |
↔ |
H3O+
+ NO3- |
основание |
Вода может быть как окислителем: 2Na + 2H2O
→ 2NaOH + H2↑
так и восстановителем: 2F2
+ 2H2O
→ 2HF + O2↑
Вода
является всеобщим, универсальным растворителем, она в какой-то мере растворяет
всё, с чем соприкасается, поэтому воду можно рассматривать как сложную
дисперсную систему. Примесями пресных вод являются химические элементы и
вещества, содержащиеся в породах, в которых располагается данный водный
источник.
Все химические элементы, присутствующие в природных водах,
условно делятся на три группы в зависимости от следующих двух признаков:
- распространённости их в земной коре;
- растворимости их природных соединений.
К
первой группе относятся соединения с хорошо развитыми
обоими признаками.
Это катионы: Na+,
K+,
Ca2+,
Mg2+
и
анионы:
CO32-,
HCO3-,
Cl-,
SO42-,
которые всегда присутствуют в природных водах и их содержание может достигать
значительных величин.
Ко
второй группе
относятся соединения, у которых один из двух необходимых признаков подавлен.
Данные соединения могут быть хорошо растворимыми в воде, но иметь низкое
содержание в природе, либо - наоборот. К этой группе относятся ионы:
NH4+,
NO3-,
NO2-,
Fe2+,
Fe3+,
Al3+;
а также
SiO2
и различные органические соединения. Соединения второй группы также всегда
присутствуют в любой природной воде, но содержание их невысоко.
К
третьей группе
относятся так называемые микрокомпоненты, т.е. элементы, участвующие в
строении земной коры, но с подавленными обоими необходимыми признаками.
Содержание соединений и элементов третьей группы в природных водах низко, в
среднем около 1 мг/см3.
Это
элементы:
Hg, Pb, Cr, Cd, Sr, Mn, Mo, Al, Cl, S, Se, As, N, C.
Соединения
углерода присутствуют в гидросфере как в неорганической форме
(СО, СО2, СО32-, НСО3-,
Н2СО3),
так и в органической.
В поверхностных водах обнаружены многие тысячи органических соединений.
Разнообразие делает невозможным контроль за содержанием каждого из них.
Поэтому компетентными органами стран Европейского сообщества выделены 13 групп
приоритетных загрязняющих компонентов, включающих около 200 индивидуальных
веществ. Классификационные группы с примерами веществ перечислены ниже:
Хлорорганические пестициды (гептахлор, ДДТ, линдан);
Фосфорорганические пестициды (дихлофос, кумафос);
Пестициды на основе феноксиуксусной кислоты (2,4 - Д, дихлорпроп, мекопроп);
Азотосодержащие пестициды на основе триазина и мочевины (атразин,
2,4,6-трихлор-1,3,5-триазин);
Летучие хлорорганические соединения (бензилхлорид, винилхлорид,
1,2-дибромэтан, 1,1- и 1,2-дихлорэтаны, 1,2-дихлорпропан, 1,3 и
2,3-дихлорпропены, хлоропрен);
"Малолетучие" хлорорганические соединения (гексахлорбутадиен, хлорнафталины);
Хлорфенолы (пентахлорфенол, трихлорфенол);
Хлоранилины и хлорнитроароматические соединения (дихлоранилин);
Полихлорированные и полибромированные бифенилы (2,3 и 2,4 и 4,4 -
дихлорбифенилы, 2,2, 4,4, 5,5 - гексахлорбифенилы, 2,2, 4,5- тетрахлорбифенилы);
Ароматические углеводороды (бензол, n-ксилолы, кумол, толуол, этилбензол);
ПАУ (антрацен, без(а)пирен);
Металлорганические соединения (дибутилдихлорид олова, тетрабутилолово,
диметилртуть, метилртуть);
Другие соединения (бензидин, бифенил, пиразон).
Суммарное содержание органических примесей в воде определяют
по величине
БПК -
биологической потребности в кислороде.
Биохимическая потребность в кислороде.
В природной воде живут так называемые аэробные бактерии, которые питаются
органическими веществами, окисляя их с помощью растворённого в воде кислорода.
Органические соединения содержат следующие элементы:
С, Н, О,
S, N, P.
Органические
вещества, способные окисляться бактериями, называются
биоразложимыми.
В результате реакций окисления элементы, составляющие органические вещества,
превращаются в
СО2,
Н2О, SO42-, NO3-, PO43-,
PO33-.
В результате
протекания окислительных реакций содержание кислорода в воде понижается.
Количество растворённого кислорода, необходимого для разложения всех
биоразложимых органических веществ, находящихся в воде, называется
биохимической
потребностью в кислороде.
Суммарной пробой
на органические загрязнители в воде является пятидневная
БПК,
обозначаемая
БПК5.
БПК5
вычисляют по понижению содержания кислорода в воде при 20oС за 5
суток. У питьевой воды
БПК5 не превышает 1,5 млн.д. кислорода; канализационная вода до
предварительной обработки имеет
БПК5 до 400 млн. д. кислорода.
Одна миллионная
доля (1 млн. д.) подразумевает одну молекулу примеси на миллион молекул
основного вещества, или 1 грамм примеси на миллион грамм основного вещества.
Следовательно, 1,5 млн.д. - это 1,5 мг О2 в 1 дм3 воды,
400 млн.д. - 400 мг О2 в 1 дм3 воды. Если
БПК5
не превышает 30 млн.д. (30 мг/дм3), вода считается чистой, с
БПК5
от 30 до 80 млн. д. - слабо загрязненной. Если же
БПК5
превышает 80 млн.д. - сильно загрязненная.
Если
содержание органических загрязнителей в источнике высоко, содержание кислорода
может понизиться до такого низкого уровня, что существование аэробных бактерий
станет невозможным.
Дальнейшее разложение органических веществ будет продолжено анаэробными
бактериями в условиях отсутствия кислорода или его низкого содержания. Под
влиянием анаэробных бактерий элементы органических соединений будут
восстанавливаться, образуя: NH3,
H2S,
PH3,
CH4.
Такой водный источник приобретает отвратительный гнилостный запах.
Поверхностно-активные вещества.
Большую
группу органических загрязнителей составляют
ПАВы - поверхностно-активные вещества, к
которым относятся стиральные порошки и все моющие средства, образующие пены.
Благодаря своему строению
ПАВы, полярной
частью молекул растворяются в воде, а неполярной ориентируются в неполярную
фазу - воздух. Поверхность воды покрывается пеной, препятствующей нормальной
аэрации воды. Водный источник обедняется кислородом, что может привести к
гибели его обитателей.
Наиболее опасными из органических
загрязнителей являются диоксины, признанные в мире абсолютным ядом.
Диоксины попадают в окружающую среду из природных и, в основном, из
техногенных источников. Диоксины - ароматические органические соединения,
относящиеся к классу простых эфиров. Наиболее токсичными являются
галогенопроизводные диоксинов, в частности,
2,3,7,8-тетрахлордибензопарадиоксин. С органическими веществами диоксины
образуют прочные комплексы, поэтому они накапливаются в микроорганизмах и
растениях. В водоёмах диоксины первоначально
накапливаются в донных отложениях и частично поглощаются природным
зоопланктоном. По мере образования растворимых компонентов с
органическими веществами диоксины переходят в воду, где они вызывают
перерождение аэробных бактерий или уничтожают их. Такой водоём заселяется
анаэробными бактериями, а также фотосинтезирующими бактериями, которые
относительно устойчивы к воздействию диоксинов. Подобные водоёмы становятся
источником разрушения прибрежных экосистем. Способность диоксинов к
комплексообразованию приводит к повышению их концентрации в источниках в
десятки раз выше ожидаемой на основе их растворимости. Диоксины являются ядами
для высших животных и человека. По мере прохождения диоксинов по биологической
цепи, на каждой стадии происходит аккумуляция и, следовательно, увеличение
концентрации диоксинов, причём, увеличение концентрации может быть от 10 до
100 раз. Кроме того, диоксины накапливаются в организмах высших животных и
человека. Время полураспада диоксинов в организмах составляет 10 - 12 лет. В
настоящее время приняты нормы допустимого попадания диоксинов в организм
человека. В разных странах эта норма составляет от 10-11 до 10-14 мг на один кг массы человека в сутки.
Очень многие металлы являются загрязнителями водных
источников. В настоящее время это практически все элементы - металлы таблицы
Д. И. Менделеева. Металлы значительно отличаются друг от друга по токсичности
и по разнообразию вызываемых ими эффектов.
Наиболее токсичными из них являются: ртуть, свинец,
кадмий, стронций, бериллий.
Токсичность металла меняется
в зависимости от его химического состояния и от тех преобразований, которые он
претерпевает в природной среде. Но очень важно ещё и
то, что в природных условиях, в частности, в водных источниках любое вещество
может вступать в реакции, которые иногда превращают его из относительно
безвредного в смертельно опасное. Высокая токсичность данных
металлических соединений объясняется тем, что они легко "взламывают"
биологическую защиту организма, проникая в кровь и отравляя весь организм.
Водородный показатель.
Реакция природной водной среды в естественных уровнях
изменяется в широком диапазоне значения
рН. Этот
фактор является очень важным, если учесть, что показатель реакции среды - один
из важнейших классификационных признаков природных вод. Большинство природных
вод имеет величину
рН в пределах от 5 до 8,5;
для подземных вод этот показатель ещё шире. Чтобы понять, почему природные
воды имеют столь широкий диапазон значения
рН, рассмотрим идеальный
случай: чистая природная вода находится в равновесии лишь с
СО2,
присутствующем в атмосферном воздухе. Парциальное давление атмосферного
углекислого газа составляет 10-7
÷ 10-8,5
Па, константа диссоциации угольной кислоты по первой ступени равна 4,8 · 10-7.
При этих условиях
рН воды составит 5,63 (это
рН
"чистого" дождя). Именно эту величину
рН принимают за отправную
точку при оценке кислотности природных вод. Однако в реальности содержание
форм угольной кислоты в водах зависит не только от растворенного
СО2,
но и от концентраций различных карбонатов. Карбонаты широко присутствуют как в
донных отложениях водных источников, так и на поверхности материков (мел,
мрамор, доломит). СаСО3 - труднорастворимая соль.
Поэтому соли угольной кислоты
в природных водоёмах могут переходить в раствор и существовать в нём только
при наличии растворённого углекислого газа:
СаСО3
+ СО2
+ Н2О
↔ Са2+
+ 2НСО3-
Образующаяся кислая соль - гидрокарбонат кальция растворима в воде, и поэтому
ионы НСО3-
включаются в общую систему карбонатных равновесий, существующую в природных
водах, и оказывают влияние на
рН воды.
Процесс
диссоциации доломита можно представить уравнением:
СаМg(CO3)2
↔ Ca2+
+ Mg2+
+ 2CO32-
Появление карбонат-ионов приводит к повышению
рН воды до 7,3 ÷ 8,4. В природных водах
одновременно могут протекать процессы, приводящие и к уменьшению, и к
увеличению водородного показателя.
К числу
процессов, приводящих к
подкислению природных вод в естественных условиях,
следует отнести:
- растворение в воде различных органических кислот с константами диссоциации,
близкими к константе диссоциации угольной кислоты. В первую очередь, сюда
относятся гуминовые кислоты в перегное лесной подстилки, которые обогащают
воды лесной зоны ионами водорода и определяют слабокислую реакцию воды;
- гидролиз природных солей, например:
FeSO4,
Fe2(SO4)3, Al2(SO4)3,
которые образуются при бактериальном окислении соответствующих сульфидов.
Рассмотрим для
примера гидролиз сульфата железа:
2FeSO4 + 2H2O ↔ H2SO4
+ (FeOH)2SO4
2Fe2+ + 2H2O ↔ 2FeOH+ + 2H+
Образующиеся в результате реакции гидролиза ионы водорода
обуславливают подкисление водной среды и растворение карбонатных пород, что
усугубляет ситуацию:
СаСО3
+ 2Н+ = Са2+ + СО2↑ + Н2О;
естественное подкисление атмосферных осадков под воздействием оксидов серы и
азота, а также летучих органических соединений в концентрациях, характерных
для континентальных воздушных масс.
Расчёт реакции среды для системы
Н2О
- СО2 (0,034 %) - SO2 (5 · 10-7 %)
даёт значение
рН = 4,6.
Как видно,
присутствие оксида серы (IV) существенно влияет на степень кислотности
осадков. Это связано с его большей по сравнению с СО2
растворимостью в воде и большей силой соответствующей кислоты.
Действие оксидов серы может быть ещё эффективнее в результате их более
глубокого окисления в капле до
Н2SO4
в присутствии катализаторов
(Fe2+, Mn2+).
В США был
зарегистрирован дождь с
рН = 4, что объясняется не
природными, а исключительно антропогенными воздействиями. Наряду с факторами,
приводящими к понижению
рН природных вод, действуют
факторы, вызывающие
повышение основности вод.
Одной из важнейших особенностей большинства природных вод является способность
нейтрализовать ионы водорода. Эта способность воды называется
щелочностью. Важнейшим, повсеместно присутствующим в
атмосфере газом, имеющим основную реакцию, является аммиак. Аммиак эффективно
нейтрализует растворённые в капле воды кислоты, в первую очередь, серную.
Расчёт реакции среды для системы:
Н2О
- СО2
(0,034 %) - SO2
(5 · 10-7
%) - NH3
(10-7
%) показывает повышение
рН до
5,8.
К числу процессов, приводящих к повышению щелочности природных вод, также
относятся:
- гидролиз природных солей, образованных сильными основаниями и слабыми
кислотами. Все главные катионы, находящиеся в воде (К+, Na+,
Ca2+)
соответствуют сильным основаниям. Их соли с анионами слабых кислот
гидролизуются с образованием гидроксид-ионов:
2СаСO3
+ 2H2O
↔ Са(НСО3)2
+ Са(OH)2
СО32-
+ H2O
↔ HСО3-
+ ОH-
процессы фотосинтеза в освещенных водоемах. Организмы, для существования
которых необходима щелочная среда (рН
> 8) для получения углерода в виде СО2
должны расщеплять другие компоненты карбонатной системы:
НСО3-
→ СО2(раств)
+ ОН-(раств)
В результате рН
природных вод может увеличиваться до 8,5 ÷ 10,5.
Основными компонентами, ответственными за связывание ионов водорода, являются
анионы НСО3-,
СО32-
и ОН+.
Основными химическими реакциями связывания Н+
являются:
НСО3-
+ Н+
↔ Н2СО3
СО32-
+ Н+
↔ НСО3-
ОН-
+ Н+
↔ Н2О.
Таким образом, щелочность воды можно определить как сумму
концентраций анионов: Σ
([HCO3-]
+ [CO32-]
+ [OH-])
моль/л.
Величина щелочности природных вод имеет большое значение с точки зрения
фотосинтеза, протекающего в водоёмах. В упрощенном виде уравнения фотосинтеза
могут быть представлены следующим образом:
|
|
hν |
|
|
СО2(Г) + Н2О |
→ |
СH2О + O2 |
|
|
hν |
|
|
HСО3- + Н2О |
→ |
CН2О + O2 + OH- |
Как видно из уравнения, при синтезе из минеральных форм углерода органических
в растворе повышается
рН.
Количество
образовавшихся органических соединений зависит от содержания СО2,
НСО3- в воде и от щелочности воды. Иногда в природных
водоёмах в связи с бурным протеканием процессов фотосинтеза и недостаточного
поступления углекислого газа
рН поднимается до 10 и выше.
Высокие значения
рН,
как и низкие, отрицательно сказываются на развитии водных экологических
систем.
Кислотно-основная буферность природных вод и окислительно-восстановительные
процессы в гидросфере
Под кислотно-основной буферностью природных вод понимается их
способность противостоять изменению
рН и поддерживать его величину в определенных пределах.
В поддержании постоянного значения
рН природных вод важную роль играют компоненты
кислотности и щелочности, принцип действия которых определяется наличием двух
взаимосвязанных равновесных систем:
диссоциации и
гидролиза.
Рассмотрим это на примере наиболее распространённых в природе карбонатных
систем, которые в пресных водоёмах и создают, в основном, буферность:
СО2 + Н2О ↔ Н2СО3
↔ Н+ + НСО3-
2СаСО3 + 2Н2О ↔ Са(НСО3)2 + Са(ОН)2
СО32- + Н2О ↔ НСО3-
+ ОН-
Очевидно, что буферность является очень важной
характеристикой природных вод. Окислительно-восстановительные процессы играют
очень важную роль как в природных водоёмах, так и в очистных сооружениях. Рост
потребления кислорода в связи с увеличением содержания органических
загрязнителей может оказаться фатальным для рыб, обитающих в данном водоёме, а
скорость окисления примесей различного происхождения является лимитирующей
стадией при работе систем водоочистки. Качество природных вод в значительной
степени зависит от типов окислительно-восстановительных реакций и их
кинетических характеристик. Необходимо подчеркнуть две особенности,
характерные для окислительно-восстановительных реакций в природных водах.
Большинство наиболее важных окислительно-восстановительных реакций в водоёмах
катализируются микроорганизмами. Например, окисление органических веществ
кислородом, восстановление Fe3+ в Fe2+; при рассмотрении
окислительно-восстановительных процессов в гидросфере необходимо проводить
аналогию с кислотно-основными реакциями.
Концентрация ионов водорода характеризует кислотно-основные свойства воды.
Так, воду
шахтных выработок, имеющих высокую концентрацию ионов водорода, называют
кислой, а воду минеральных источников с высоким содержанием гидроксид-ионов -
щелочной. По аналогии вода с высокой концентрацией свободных электронов
называется восстановительной (например, сероводородные воды Черного моря).
Вода с низкой концентрацией электронов называется окислительной (например,
хлорированная или озонированная вода из крана). Необходимо помнить, что
раствор свободных электронов
(е) в воде такая же удобная условность, как и
раствор негидратированных протонов
(Н+).
Перенос
электронов в окислительно-восстановительных реакциях всегда сопровождается
переносом протонов
(Н+), обуславливая тем самым жёсткую взаимосвязь между
окислительно-восстановительными процессами в природных водах и их
кислотно-основным равновесием.
Например, в
нейтральной фазе протекает процесс:
Fe2+ + 3H2O - e → Fe(OH)3↓ + 3H+
Окислительно-восстановительное равновесие в природных водоёмах определяется, в
основном, двумя процессами:
фотосинтезом,
бактериальным разложением органического вещества.
В результате фотосинтеза
неорганические соединения, СО2
и НСО3-,
образуют органический углерод и кислород:
СO2
+ hν → Сорганич
+ O2
В
отсутствие фотосинтеза атмосферный кислород расходуется на окисление
органического вещества до полного исчезновения кислорода. Помимо кислорода и
углерода для органического фотосинтеза требуется азот и фосфор. В
незагрязненных пресных водах лимитирующими питательными веществами являются
фосфаты, в загрязнённых водах фотосинтез обычно лимитируется нитратами.
Средний состав органического вещества
фитопланктона
определяется приближённой формулой: С106Н263О110N16P.
При распаде органическое вещество такого состава становится потенциальным
потребителем 138 молекул кислорода: С106Н263О110N16P
+ 138О2
→ 106СО2
+ 16NO3-
+ HPO42-
+ 122H2O
+ 18H+.
Окислительно-восстановительная система в состоянии равновесия
является идеальным случаем, так как в реальных природных, а тем более в
аквариуме равновесие практически никогда не достигается.
Основу материала
составила информация сайта www.ssga.ru, а
также информация из прочих источников. Для желающих узнать еще больше о воде и ее свойствах, рекомендую посетить
сайт www.lsbu.ac.uk.
 Вопрос кажется банальным, но…
Вопрос кажется банальным, но…
 Вода
имеет полярную молекулу. Кислород как более электроотрицательный атом
оттягивает на себя общую с атомом водорода электронную плотность к себе и
потому несет частичный отрицательный заряд; атомы водорода, от которых
электронная плотность смещена, несут частичный положительный заряд. Таким
образом, молекула воды представляет собой
диполь,
т.е. имеет положительно и отрицательно заряженные участки.
Вода
имеет полярную молекулу. Кислород как более электроотрицательный атом
оттягивает на себя общую с атомом водорода электронную плотность к себе и
потому несет частичный отрицательный заряд; атомы водорода, от которых
электронная плотность смещена, несут частичный положительный заряд. Таким
образом, молекула воды представляет собой
диполь,
т.е. имеет положительно и отрицательно заряженные участки.